Insulin
aus Wikipedia, der freien Enzyklopädie
Insulin ist das blutzuckersenkende Peptid-Hormon und der Gegenspieler des Glucagons. Es spielt eine wesentliche Rolle bei der Regulierung des Blutzuckers und der Therapie des Diabetes mellitus.
Inhaltsverzeichnis |
[Bearbeiten] Allgemeines
Der Name Insulin leitet sich von den Langerhansschen Inseln der Bauchspeicheldrüse (Pankreas) her, deren Beta-Zellen das Insulin bilden.
Insulin besteht aus zwei Peptidketten, der A-Kette mit 21 und der B-Kette mit 30 Aminosäuren, welche durch zwei Disulfidbrücken zusammengehalten werden. Die dritte Disulfidbrücke verbindet die Cysteinreste der Positionen 6 und 11 der A-Kette.
Humaninsulin -------------------
/ \
Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn
\ /
\ /
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr
Die Halbwertszeit liegt etwa bei einer halben Stunde. Insulin ist für Tiere und den Menschen ein lebensnotwendiges Hormon.
Es steht auf der Liste der verbotenen Dopingsubstanzen.
[Bearbeiten] Geschichte
| 1869 | Paul Langerhans entdeckt die Inselzellen im Gewebe der Bauchspeicheldrüse. |
| 1889 | Ein Meilenstein zum Verständnis der Erkrankung Diabetes: Die deutschen
Ärzte Oskar Minkowski
(1858–1931) und
Joseph von Mering (1849–1908) entfernen an Hunden die Bauchspeicheldrüse und lösen dadurch akut die Krankheit Diabetes mellitus aus. Bereits kurz darauf werden die von Paul Langerhans 1869 entdeckten Inselzellen als endokrines (= hormon-produzierendes) Gewebe vermutet. |
| 1903 | Erstmals ein Ansatz zur Therapie der Erkrankung Diabetes: Der deutsche Internist Georg Ludwig Zülzer (1870-1949) entwickelte ein therapeutisches Bauchspeicheldrüsenextrakt, das den Blutzucker senken konnte. Wegen allergischer Nebenwirkungen war es jedoch am Menschen nicht gebrauchsfähig. |
| 1909 | taucht erstmals der Begriff “Insulin” = von den Inseln kommend auf. |
| 1910 | Der englische Physiologe Edward Albert Sharpey-Schafer nannte die den Diabetikern fehlende Substanz aus der Bauchspeicheldrüse “Insulin”. [1] |
| 1916 | gelang es Nicolae Paulescu
erstmals, Insulin aus Pankreasgewebe zu gewinnen.
Er nannte das Präparat Pankrein. Es war bei einem diabetischen Hund wirksam. |
| 1921 | veröffentlichte Paulescu seine Erkenntnisse. |
| 1921 | gelang auch Frederick
Banting und Charles Best die
Extraktion von Insulin, sie nannten es “isletin”.
Auch sie führten ihre Experimente an Hunden durch, denen die Bauchspeicheldrüse operativ entfernt worden war. Sie bestätigten in ihren Publikationen die Arbeiten Paulescus. Frühere Versuche anderer Wissenschaftler waren jedoch nicht erfolgreich, da sie die komplette gemahlene Bauchspeicheldrüse verwendeten, wobei andere Verdauungssäfte des Pankreas das Insulin zerstörten. |
| 1922 | ließ Paulescu das Herstellungsverfahren für Pankrein in Bulgarien patentieren. |
| 1922 | gelang Banting und Best die erste Rettung eines Diabetikers, eines 13 Jahre alten Jungen, der seit eineinhalb Jahren an der Krankheit litt und bereits ins Koma gefallen war. |
| 1923 | erhielten Banting und John James Richard Macleod, der Leiter des Instituts, den Nobelpreis für Medizin. Sie teilten den Preis freiwillig mit Best und James Collip, der einen verbesserten Extrakt erfunden hatte. In den folgenden Jahrzehnten wurde Insulin aus den Bauchspeicheldrüsen von Rindern und Schweinen großtechnisch gewonnen. Rinder- und Schweineinsulin unterscheiden sich vom menschlichen Insulin nur geringfügig, beim Schwein ist nur eine, beim Rind sind drei Aminosäuren durch andere Aminosäuren ersetzt. Obwohl auch tierisches Insulin beim Menschen wirkt, wurde trotzdem versucht, menschliches Insulin zu produzieren, da die Behandlung mit unmodifiziertem tierischen Insulin oft zu schwerwiegenden immunologischen Nebenreaktionen führte. |
| 1923 | brachte Lilly das erste Insulinpräparat "Isletin" auf dem Markt. Die Firma Lilly hatte mit Banting und Best zusammengearbeitet. [2] |
| 1926 | gelang es John Abel, Insulin in kristalliner Form darzustellen. |
| 1928 | gelang Oskar Wintersteiner der Nachweis, dass Insulin ein Protein ist. |
| 1934 | entwickelte E. Scott das erste Zinkinsulin. |
| 1936 | Neutrales Protamin Hagedorn |
| 1955 | Nach zwölfjähiger Arbeit publiziert Frederick Sanger die komplette Aminosäurensequenz des Insulins. |
| 1958 | Der zweite Nobelpreis in der Geschichte des Insulins, diesmal im Bereich Chemie, geht an Frederick Sanger "für seine Arbeiten über die Struktur der Proteine, besonders des Insulins". |
| 1960 | Nicol und Smith beschrieben die Struktur von Humaninsulin. |
| 1963 | gelang Professor Helmut Zahn und seinem Team am Deutschen Wollforschungsinstitut in Aachen die weltweit erste chemische Synthese des Insulins. Auf Grund der über 200 Synthesestufen, konnte diese Insulinsynthese jedoch noch nicht industriell genutzt werden. Sie räumte allerdings mit dem Vorurteil auf, dass man Proteine nicht synthetisieren könne. |
| 1979 | Obermaier und Geiger: Humaninsulin-Synthese |
| 1982 | gelang es erstmals, Humaninsulin durch gentechnisch veränderte Bakterien in großer Menge herzustellen. Inzwischen übernehmen auch Hefepilze diese Aufgabe. |
| 1996 | Lyspro/Humalog war das erste schnellwirkende Insulinanalogon. |
| 2002 | Aspart/Novorapid kam als zweites "Turboinsulin" auf den Markt. |
| 2003 | Glargine/Lantus war das erste langwirkende Analoginsulin. |
| 2004 | Detemir/Levemir wurde als zweites Langzeit-Analogon verfügbar. |
| 2006 | Glulisin/Apidra war das dritte schnellwirkende Analogon. |
[Bearbeiten] Biochemie
[Bearbeiten] Biosynthese von Insulin
Insulin wird in den so genannten beta-Zellen der Langerhansschen Inseln des Pankreas synthetisiert
- Die mRNA wird zunächst in ein inaktives Präproinsulin übersetzt (Peptid aus 107 Aminosäuren), bestehend aus einer Signalsequenz (leader), an die sich zunächst die 30 Aminosäuren der B-Kette schließen und nach einem C-Peptid (connecting peptide) die A-Kette aus 21 Aminosäuren folgt.
- Durch Abspaltung der Signalsequenz und Bildung von drei Disulfidbrücken (zwei zwischen A-und B-Peptid, eine innerhalb des A-Peptids) entsteht das Proinsulin (84 Aminosäuren). Im Verlauf der weiteren Reifung wird die C-Kette durch spezifische Peptidasen abgespalten. Das Insulinmolekül liegt dann als Hexamer durch ein Zinkion stabilisiert in Granula an der Zellmembran der beta-Zelle gespeichert vor.
- Ein steigender Blutzuckerspiegel (ab ca. 4 mmol Glucose / L Blut) als Sekretionsreiz führt schließlich durch Verschmelzen der Membranen (Exocytose) zur Entleerung des Granulainhaltes in den Extrazellulärraum.
[Bearbeiten] Biochemische Wirkungen von Insulin
Die metabolischen und mitogenen Effekte von Insulin werden über die Bindung an dessen Rezeptor auf der Zelloberfläche der Zielgewebe Leber, Muskel und Fett initiiert. Eine der wichtigsten biologischen Wirkungen des Insulins ist die rasche Beschleunigung der Glucoseaufnahme in Muskel- und Fettzellen. Insulin induziert weiterhin die Glykogensynthese und -speicherung in Leber und Muskel, die Triglyceridsynthese in Leber und Fettgewebe sowie die Speicherung von Aminosäuren im Muskel. Gleichzeitig hemmt Insulin die hepatische Gluconeogenese und zählt daher insgesamt zu den wichtigsten Regulatoren des Glucosemetabolismus. Eine weitere zentrale Funktion des Peptidhormons Insulin besteht in der Regulation von Zellwachstum und Proliferation durch die Aktivierung der Transkription von Genen, die für Kontrolle und Ablauf des Zellzyklus von großer Bedeutung sind.
Der Insulinrezeptor wird nahezu in allen Zellen exprimiert. Seine Anzahl reicht von wenigen hundert Rezeptoren auf Erythrocyten bis zu mehreren hunderttausend auf Adipocyten und Hepatocyten. Der Insulinrezeptor ist ein heterotetrameres Glykoprotein und setzt sich aus zwei extrazellulären alpha-Untereinheiten und zwei die Zellmembran durchspannenden beta-Untereinheiten zusammen, welche durch Disulfidbrücken kovalent miteinander verbunden sind. Nach der Bindung von Insulin an die alpha-Untereinheiten kommt es im Zellinneren zur Autophosphorylierung der beta-Untereinheiten des Rezeptors. Intrazelluläre Adaptorproteine binden daraufhin an den Rezeptor und werden an spezifischen Aminosäureresten phosphoryliert. Das Insulinsignal wird dann über diese Adaptorproteine durch die Bildung von Signalkomplexen an verschiedene intrazelluläre Signalkaskaden gekoppelt. Zwei Hauptkaskaden propagieren das durch den Insulinrezeptor generierte Signal, der PI 3-Kinase-Signalweg und der MAP-Kinase-Signalweg. Diese Signalwege koordinieren konzertiert die vielfältigen Prozesse in der Zelle, wie beispielsweise die rasche Glucoseaufnahme durch Translokation des Glucosetransporters GLUT4 an die Zelloberfläche, den Glucose-, Lipid- und Proteinmetabolismus und die Genexpression. Die genaueren molekularen Signalwege in der Zelle werden aktiv bearbeitet.
[Bearbeiten] Zelluläre Wirkungen von Insulin
- In der Leber und der Muskulatur werden die mit der Nahrung aufgenommenen Kohlenhydrate als Glykogen gespeichert. Dies hat ein Absinken der Glucosekonzentration im Blut zur Folge.
- In der Leber, dem Fettgewebe und der Muskulatur wird unter Insulineinfluss die Triglyceridsynthese stimuliert. Substrate dafür sind neben den Kohlenhydraten mit der Nahrung aufgenommene Lipide.
- In den drei genannten Geweben werden Aminosäuren verstärkt aufgenommen und für die Proteinsynthese verwendet
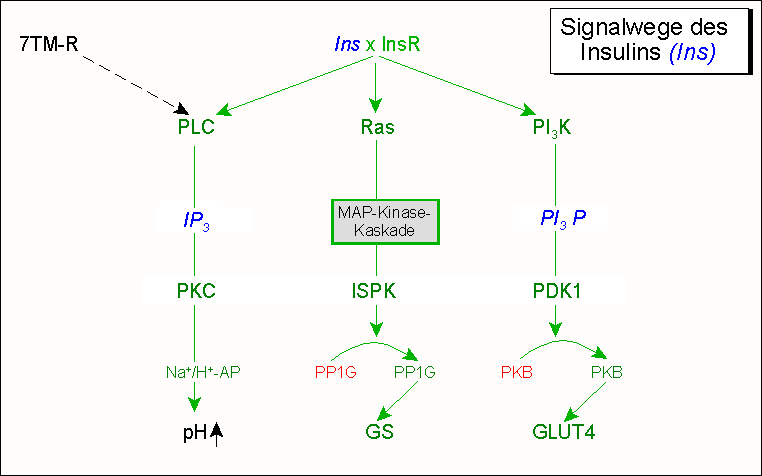
[Bearbeiten] Durch Insulin ausgelöste Signalwege
Der Organismus signalisiert durch Ausschüttung des Insulins einen zu hohen Blutzuckerspiegel. Dieses Signal wird durch Anschalten Glucose-verbrauchender Wege, insbesondere in der Leber, beantwortet. Drei dieser Wege sind im folgenden schematisch dargestellt:
Abbildung: Drei wichtige durch Insulin ausgelöste Signalwege
- PLC/IP3-Weg: Phospholipase C (PLC) reagiert nicht nur auf Signale von 7-Transmembranhelix Rezeptoren (7TMR) sondern auf solche des Insulin Rezeptors (InsR). Aus Phosphatidylinositol-4,5-bisphosphat (PIP2) werden damit die second messenger Inositol-1,4,5-triphosphat (IP3) und Diacylglycerin freigesetzt, die zusammen Proteinkinase C aktivieren. Ein Substrat der PKC ist der Natrium-Protonen Antiport, der bei Na+-Einstrom gleichzeitig H+ aus der Zelle pumpt und damit den pH-Wert des Cytosols leicht anhebt. Diese Milieuänderung hat die Aktivierung des Schlüsselenzyms Phosphofructokinase und damit erhöhten Glucoseverbrauch zur Folge.
- MAP-Kinasekaskade: wie unter Blutzucker besprochen, aktiviert dieser Weg die Insulin-stimulierte Proteinkinase (ISPK). Diese phosphoryliert und aktiviert die Proteinphosphatase PP1G. PP1G dephosphoryliert Glykogen-Synthase, die hierdurch aktiviert wird. Durch diesen Vorgang wird Glucose (bei hoher Energieladung) dem Glykogenspeicher zugeführt.
- PI3K-Weg. Phosphatidylinosit-3-kinase (PI3K) phosphoryliert Membrankomponenten, d.h. Phosphatidylinosite an der 3-Position, wodurch Weg 1 gesperrt wird. Diese Gruppe von Phospholipiden dient stattdessen als Membrananker für Proteinkinase B (PKB), die dann durch eine andere Phosphatidylinosit-abhängige Proteinkinase (PDK) aktiviert werden kann. PKB bewirkt, dass Vesikel, mit dem sonst auf der Zelloberfläche nicht vorhandenen Glucose-Transporter 4 (GLUT4) mit der Zellmembran in Muskel- und Fettzellen verschmelzen. Dadurch wird GLUT 4 funktionsfähig und es kann Glukose vermehrt für die Energiegewinnung herangezogen werden. Über diesen Mechanismus wird der Blutglukosespiegel rasch und effektiv gesenkt
Die drei geschilderten Wege bewirken also ein Sinken des Blutglucosespiegels durch
- Förderung der Glucose-Aufnahme (GLUT4-Translokation zur Zelloberfläche);
- Förderung der Glucose-Speicherung (Glykogen-Synthese);
- Unterstützende Maßnahmen bestehen im Abschalten Glucose-liefernder Wege, so zum Beispiel durch Abbau des second messenger cAMP über eine Phosphodiesterase.
[Bearbeiten] Gegenspieler des Insulins
Fällt der Blutzuckerspiegel im Körper unter einen Wert von 80 mg/dl ab, wird die Insulinproduktion bereits stark reduziert. Sinkt der Blutzucker weiter ab, treten verschiedene Gegenspieler des Insulins auf:
Die Spiegel dieser gegenregulierenden Hormone steigen bereits deutlich an, wenn der Blutzucker unter 60 mg /dl absinkt. Beim echten Insulinmangel des Typ I Diabetikers wird das Insulin von außen zugeführt. Da bis jetzt der Blutzuckersensor fehlt, wird die Insulinfreisetzung aus dem injizierten subkutanen Insulindepot nicht gedrosselt. Außerdem ist durch die autoimmune Zerstörung der Betazellen des Pankreas oft auch die Glukagonproduktion vermindert. Dies führt zu einer verminderten Gegenregulation und einer erheblichen Hypoglykämiegefahr ( = Unterzuckerung).
[Bearbeiten] Insulin als Medikament
- Hauptartikel: Insulinpräparat, Insulintherapie
In der Insulintherapie werden verschiedene Insulinpräparate verwendet. Die wichtigste und am längsten verwendete Verabreichungsart ist die Injektion, neueren Datums sind Präparate zur Inhalation. Oral gegeben ist Insulin unwirksam, da die Eiweißketten im Magen-Darm-Trakt von körpereigenen Enzymen abgebaut werden, bevor sie ihre Wirkung entfalten können.
[Bearbeiten] Insulinresistenz
Unter Insulinresistenz versteht man eine verminderte Wirkung des Peptidhormons Insulin in peripheren Geweben. Siehe auch: Metabolisches Syndrom.
Die Insulinresistenz ist die Hauptursache des Typ 2 Diabetes. Die genauen Mechanismen, welche zur Insulinresistenz im Menschen führen, sind derzeit weitestgehend unverstanden, werden aber intensivst erforscht.
In diesem Zusammenhang werden neben einer polygenetischen Prädisposition eine Reihe von sekundären umweltbedingten Faktoren diskutiert. Hierzu zählen Adipositas (Fettleibigkeit), metabolische Faktoren, Alter und Mangel an körperlicher Aktivität. Nicht von allen Wissenschaftlern wird der Einfluss von kohlenhydratreichen Lebensmitteln mit einem hohen Glykämischen Index akzeptiert.
Besserungen beim Patienten mit einer Reduktion der Insulinresistenz werden im allgemein erreicht durch:
- Bewegung
- eine (z.B.ärztlich) betreute Diät (mit Gewichtsabnahme)
- Insulinsensitizer
- Bestimmte orale Antidiabetika
- Rimonabant
[Bearbeiten] Insulinanaloga
Insulinanaloga sind vom Humaninsulin abgeleitete Strukturvariationen, also modifizierte Insuline. Durch gentechnologische Methoden wurden einzelne der insgesamt 51 Aminosäuren mit dem Ziel ausgetauscht, ein verändertes bzw. vorteilhafteres Wirkungsprofil zu erreichen. So sind heute mittlerweile kurz- und langwirkende Insuline für Diabetes-Patienten verfügbar. Zum Beispiel wurde durch den Austausch der Aminosäuren Lysin und Prolin an den Positionen 28 und 29 der B-Kette des Insulins das kurzwirksame Analogon Lispro (Humalog) generiert, welches sich durch einen rascheren Wirkungseintritt und eine kürzere Wirkungsdauer, bedingt durch die Tatsache, dass die einzelnen Moleküle im Unterhautfettgewebe frei vorliegen (Normalinsulin: Hexamere), auszeichnet. Weitere Insulinanaloga sind Glargine (Lantus), Aspart (NovoRapid),Glulisin (Apidra), Insulindetemir (Levemir).
[Bearbeiten] Risiken der Insulinanaloga
Das erste Analoginsulin - Lispro -, ein kurzwirkendes Insulin, wird weltweit in der Diabetestherapie seit 10 Jahren eingesetzt. In der Zulassungsstudie wurde das vermehrte Retinopathierisiko nicht grundsätzlich ausgeschlossen. Aus diesem Grund kamen diverse Formulierungen auf, die Patienten das Fürchten von Analoginsulinen beibrachten. Mittlerweile existieren wissenschaftlich saubere Studien, die ein erhöhtes Retinopathierisiko durch Lispro ausschließen.
Das Langwirkende Analoginsulin - Lantus - (Insulin glargin) wird als Förderer von Augenschädigungen diskutiert. Dabei kann bei einer (mit Lantus leicht möglichen) schnellen Einstellung von vorher schlechten auf sehr gute Blutzuckerwerte eine Retinopathie auftreten.
Im deutschen Gesundheitswesen wurde diskutiert, ob den deutlich höheren Kosten der Analoginsuline auch ein deutlich höherer Nutzen gegenüber steht. Darüber hatte insbesondere der Gemeinsame Bundesausschuss zu entscheiden. (www.g-ba.de/cms/upload/pdf/news/Themen-Nutzenbewertung-Insulinanaloga.pdf) Besondere Beachtung findet innerhalb der genannten Kosten-Nutzen-Diskussion eine vom Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) im Februar 2006 veröffentlichte Untersuchung (siehe www.iqwig.de/index.140.html). In dieser Untersuchung sind sieben so genannte RCT-Studien als Grundlage einer Nutzenbewertung kurzwirksamer Insulinanaloga bei Patienten mit Diabetes mellitus Typ 2 ausgewertet worden. Das IQWIG kommt zu dem Ergebnis, dass eindeutige Vorteile der Insulinanaloga nicht nachgewiesen seien. In der Folge der Veröffentlichung dieses Berichts kam es zu intensiven Diskussionen über die verwendeten wissenschaftlichen Methoden, da nur 6 von über 1000 Studien mit Analoginsulinen anerkannt wurden.
[Bearbeiten] Vor- und Nachteile kurzwirksamer Insulinanaloga
Kurzwirksame Insulinanaloga haben ein Wirkprofil zwischen 1-3 Stunden. Sie fluten rascher an und sind schneller „abgebaut“. Im Vergleich zu den klassischen „Altinsulinen“ wirken sie schneller und heftiger. Die Spürbarkeit dieses Effektes hängt aber nicht zuletzt von der Einstichstelle ab!
Ein deutlicher Vorteil lässt sich aber klar in der Praxis erkennen: Die Nachwirkzeit des Insulinanalogas ist deutlich kürzer und somit fällt in der Regel eine 2. Mahlzeit nach dem Essen (zur Kompensation des Insulinüberhangs in der 2. - 4. Stunde weg. Gleichzeitig sinkt damit auch das Hypoglykämierisiko.
[Bearbeiten] Quellen
- ↑ http://www.expasy.org/spotlight/back_issues/sptlt009.shtml
- ↑ http://www.lilly.com/about/milestones.html
[Bearbeiten] Siehe auch:
[Bearbeiten] Weblinks
- Artikel: 80 Jahre Insulin auf dem Diabetes-Portal DiabSite
- Diabetes Info Server
- http://www.medizinfo.com/diabetes/diasto3.htm
- http://pdbbeta.rcsb.org/pdb/explore.do?structureId=1APH
- http://www.ddz.uni-duesseldorf.de/
- Portal für Eltern von Kindern mit Hyperinsulinismus
- http://www.pro-tierisches-insulin.info/ Netzwerk für den Erhalt tierischer Insuline
- http://www.modernes-tierisches-insulin.de/ Tierisches Insulin als lebensnotwendiges Medikament
- The Discovery of Insulin: A Canadian medical miracle of the 20th century (engl.)
- http://www.diabetes-world.net/68924/datenbanken/insulin-datenbank Insulindatenbank nach Wirkprofilen
- http://www.diabeti-kuss.de/ website für Betroffene von Insulinunverträglichkeiten
- http://www.diabetesvoice.org/issues/2001-12/Lessons_from_the_history_of_insulin.pdf
| Bitte beachten Sie den Hinweis zu Gesundheitsthemen! |
Kategorien: Diabetes | Hormon | Protein | Arzneistoff | ATC-A10